全球首款CLDN 18.2靶向药Zolbetuximab上市!胃癌治疗迎来新纪元
近日,安斯泰来制药集团宣布,日本厚生劳动省(MHLW)批准了zolbetuximab上市(商品名:VYLOY,佐妥昔单抗,佐贝妥昔单抗),联合化疗用于HER2阴性、Claudin 18.2阳性(CLDN18.2+)的不可切除晚期或复发性胃癌,成为目前世界首个且唯一获批的CLDN18.2靶向疗法。
安斯泰来高级副总裁兼免疫肿瘤学开发负责人Moitreyee Chatterjee-Kishore表示:“MHLW批准佐妥昔单抗上市标志着胃癌治疗新纪元的开始,为患有这种致命性疾病的CLDN18.2阳性患者提供了第一个也是唯一的靶向治疗选择。”
获批依据
此次获批是基于III期SPOTLIGHT研究和GLOW临床试验的结果。SPOTLIGHT研究对佐妥昔单抗联合mFOLFOX6(包括奥沙利铂、亚叶酸和氟尿嘧啶的联合方案)与安慰剂联合mFOLFOX6进行了比较。GLOW研究评估了佐妥昔单抗联合CAPOX(一种包括卡培他滨和奥沙利铂的联合化疗方案)与安慰剂联合CAPOX的疗效差异。
SPOTLIGHT研究
●研究设计
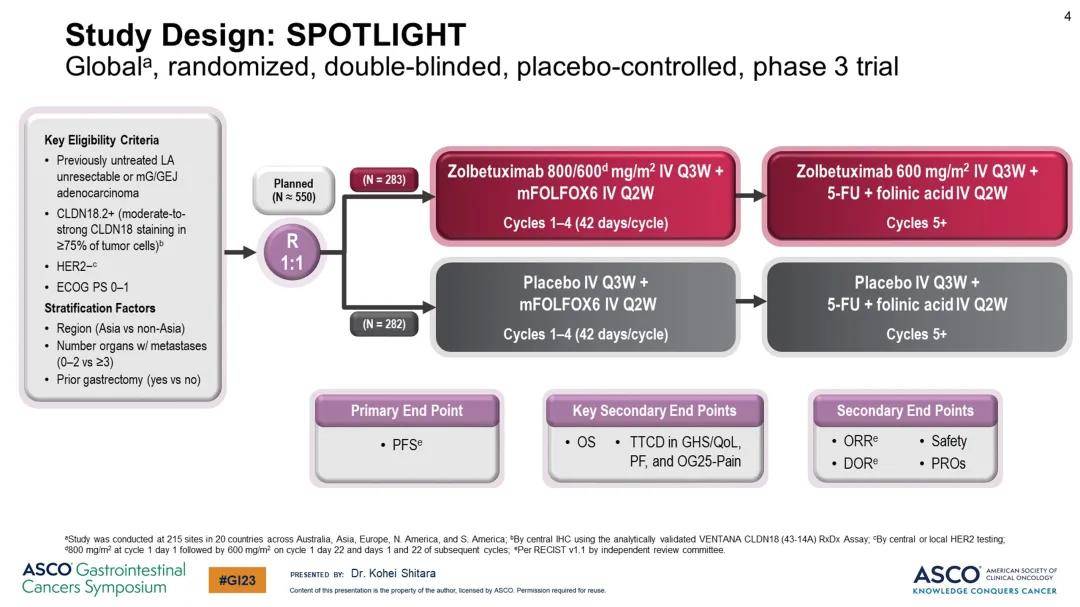
SPOTLIGHT是一项随机双盲、多中心、安慰剂对照全球III期研究,纳入了先前未经治疗的局部晚期不可切除或转移性胃/GEJ腺癌且CLDN18.2阳性的患者。为了符合入组资格,患者至少 75% 的肿瘤细胞需要具有中度至强的CLDN18染色、HER2表达阴性,且ECOG体能状态为 0 或 1 。研究参与者以 1:1 的比例随机分配接受佐妥昔单抗联合mFOLFOX6(n = 283)治疗或安慰剂联合mFOLFOX6(n = 282)治疗。
展开全文
▲研究设计
●研究结果
主要研究终点无进展生存期(PFS)和关键次要终点总生存期(OS)均实现了统计学意义的显著提升。与安慰剂联合mFOLFOX6组相比,佐妥昔单抗和mFOLFOX6联合用药将疾病进展或死亡风险降低了 24.9%(P = 0.0066),佐妥昔单抗组和安慰剂组的中位PFS(mPFS)分别为 10.61 个月和 8.67 个月。
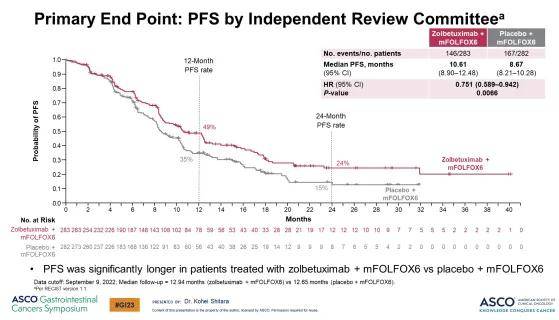
▲主要终点:独立审查中心评估的PFS
佐妥昔单抗联合mFOLFOX6显著延长了OS,将死亡风险降低了 25.0%(P =0.0053)。治疗组和安慰剂组的mOS分别为 18.23 个月和 15.54 个月。SPOTLIGHT研究的主要研究者、日本国立癌症中心东病院消化肿瘤科主任、医学博士Kohei Shitara强调:这是迄今为止在全球III期试验中有关局部晚期不可切除或转移性G/GEJ腺癌患者中观察到的最长的OS。
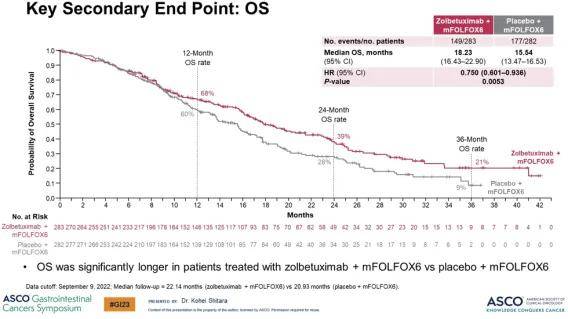
▲关键次要终点:OS
●研究结论
SPOTLIGHT研究中的佐妥昔单抗联合mFOLFOX6方案使患者在PFS和OS具有统计学意义的显著改善,在大部分亚组也观察到类似结果,安全性数据与既往研究报告数据一致。该方案是一种新的潜在标准治疗手段,适用于基于生物标志物的CLDN18.2阳性/HER2阴性的局部晚期不可切除或转移性G/GEJ腺癌患者,而且亚洲人群获益更高。此项研究也进一步支持CLDN18.2作为胃或胃食管交界处腺癌的生物标志物。
GLOW研究
●研究设计
GLOW研究是一项全球多中心、随机、双盲、安慰剂对照的III期临床试验,在亚洲、欧洲、北美和南美等地区 18 个国家、共 166 个中心开展,广泛的受试者分布奠定了此项循证研究的全球性指导价值。研究共纳入了 507 例既往未经治疗的Claudin18.2+/HER2-局部晚期或转移性胃或胃食管交界处腺癌患者,按 1:1 随机分配,分别给予 1-8 个周期(21 天/周期)的佐妥昔单抗(800/600 mg/m2,IV,Q3W)+CAPOX,从第 9 个周期开始进行接受佐妥昔单抗(600 mg/m2,IV,Q3W)+卡培他滨治疗;或者予以 1-8 个周期(21 天/周期)的安慰剂(IV,Q3W)联合CAPOX,从第 9 个周期开始进行接受安慰剂(IV,Q3W)联合卡培他滨治疗。
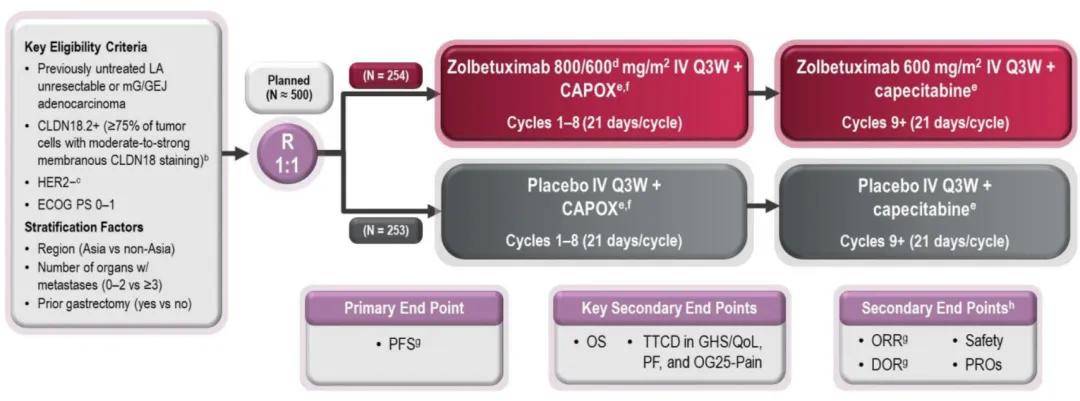
▲研究设计
●研究结果
主要研究终点无进展生存期(PFS)和关键次要终点总生存期(OS)均实现了统计学意义的显著提升。佐妥昔单抗组的 12 个月和 24 个月PFS率分别为 35% 和 14% ,安慰剂组的 12 个月和 24 个月PFS率分别为 19% 和 7% ,佐妥昔单抗组和安慰剂组的中位PFS分别为 8.21 个月和 6.80 个月,HR为 0.687(95% CI,0.544-0.866)(P=0.0007)。
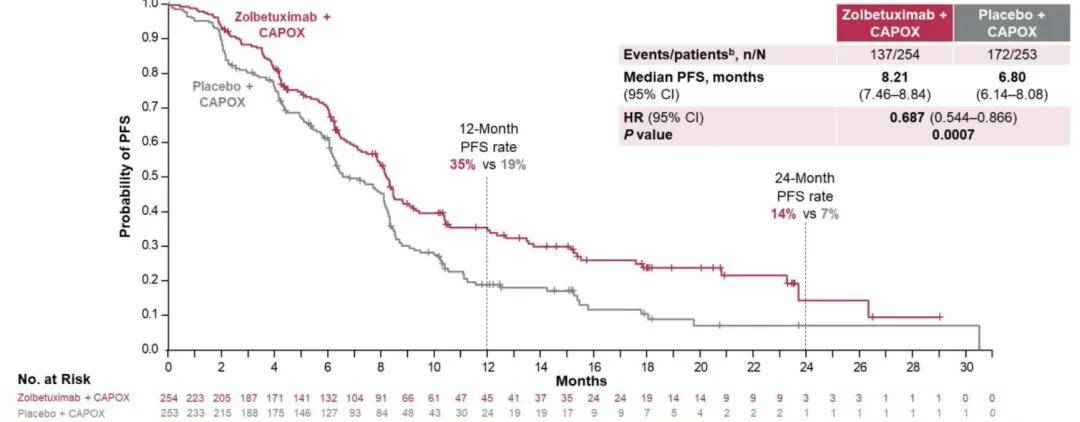
▲主要终点:PFS
佐妥昔单抗组的 12 个月和 24 个月OS率分别为 58% 和 29% ,安慰剂组的 12 个月和 24 个月OS率分别为 51% 和 17% ,佐妥昔单抗组和安慰剂组的中位OS分别为 14.39 个月和 12.16 个月,HR为 0.771(95%CI:0.615-0.965)(P = 0.0118)。
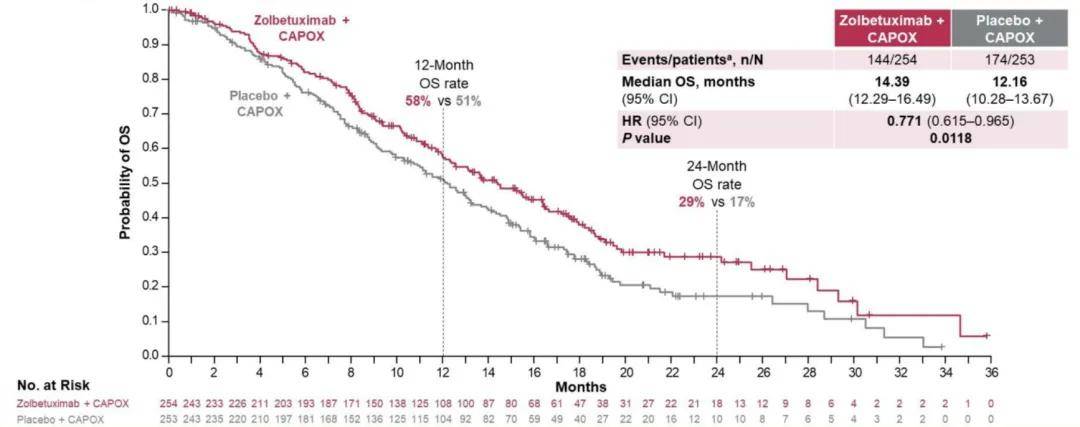
▲关键次要终点:OS
●研究结论
对于CLDN18.2阳性/HER2阴性局部晚期不可切除或转移性G/GEJ腺癌患者,佐妥昔单抗联合CAPOX一线治疗具有统计学意义和临床意义上的生存获益,PFS和OS获益持续 24 个月;佐妥昔单抗联合CAPOX治疗表现出可耐受和可管理的安全性,恶心和呕吐是最常见的TEAE,最初发作大多数发生于佐妥昔单抗治疗的第一个周期内;在佐妥昔单抗组中,恶心、呕吐在没有行胃切除术的患者中更常见。GLOW研究的疗效和安全性结果与SPOTLIGHT研究相一致。GLOW研究结果证实,佐妥昔单抗联合CAPOX是CLDN18.2+、HER2-局部晚期不可切除或转移性G/GEJ腺癌患者新的潜在一线标准治疗。
相关背景
胃癌流行病学[4]
胃癌作为全世界常见的一种恶性肿瘤,其不良预后对人类健康构成严重挑战。根据全球癌症发病率和死亡率信息中心的最新统计数据,截至 2020 年,全世界新增胃癌病例约为 108.9 万例,死亡病例约为 76.9 万例。胃癌在男性恶性肿瘤患者中的发病率和病死率均是第 4 位;在女性恶性肿瘤中的发病率居第 7 位,病死率居第 5 位。全世界范围内,胃癌的流行呈现显著的地理和人群分布差异,东亚国家如韩国、日本、我国,与北美、西欧及非洲国家比较,其胃癌的发病率和病死率均呈明显上升趋势。在全世界 185 个国家中,我国胃癌的发病率和病死率均位居榜首,分别约为 43.9% 和 48.6%。我国肿瘤登记中心最新数据显示:2016 年我国新增胃癌发病病例约为 39.7 万例,其中男性为 27.7 万,女性为 12.0 万;胃癌死亡病例约为 28.85 万例,其中男性为 20.02 万,女性为 8.84 万;发病例数和死亡人数均居所有恶性肿瘤第 3 位。
Claudin 18.2(CLDN 18.2)
Claudin18.2是一类存在于上皮和内皮紧密连接中的整合素膜蛋白,具有高度组织表达特异性,在多种肿瘤组织中高度表达且频率较高,比如胃癌(60%-80%)、胰腺癌(50%)、食管癌(30%-50%)和肺癌(40%-60%)等,但在正常组织中几乎没有表达[5]。因此,这一正常组织局限性表达而肿瘤中特异性高表达的特点使Claudin18.2成为了实体瘤免疫疗法开发的一个理想靶点。
目前,Claudin 18.2检测已被纳入2023CSCO胃癌诊疗指南推荐(III级推荐,2B类),同时在注释中指出对于标准治疗失败的晚期或复发胃癌患者,为了寻找潜在的治疗靶点,可进行Claudin 18.2、FGFR2、c-MET等标记物检测。
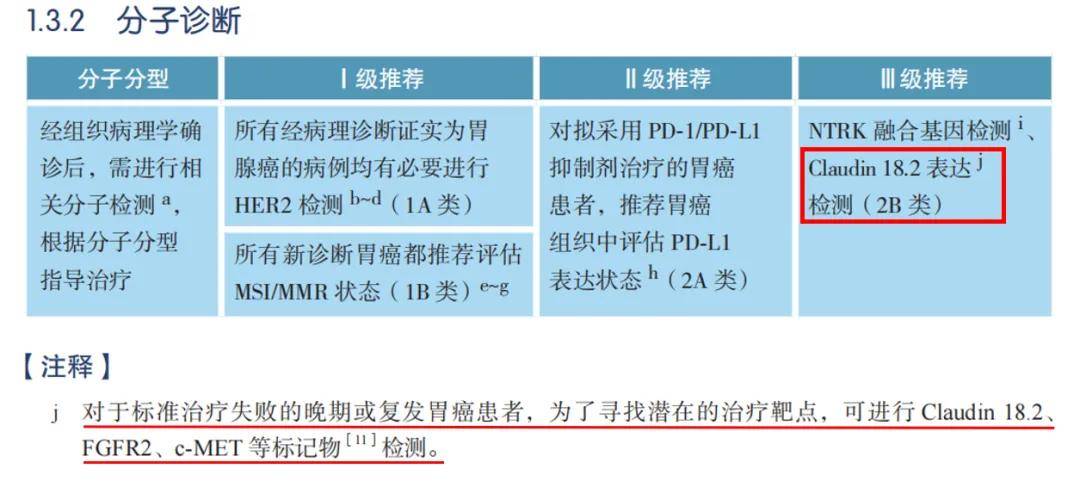
▲摘自《CSCO胃癌诊疗指南2023版》
我司可提供Claudin 18.2表达检测,详情请见往期推文:新品上市—Claudin 18.2蛋白表达检测,新型抗癌靶点拓宽患者治疗可能。

▲绘真医学Claudin 18.2蛋白表达检测项目
参考文献:
[1]Japan’s MHLW Approves Zolbetuximab in CLDN18.2-Positive Gastric Cancer.
[2]安斯泰来官网./
[3]2023ASCO会议摘要.
[4]中华医学会肿瘤学分会早诊早治学组 . 胃癌早诊早治中国专家共识(2023版)[J]. 中华消化外科杂志, 2024, 23(1): 23-36. DOI: 10.3760/cma.j.cn115610-20231207-00239.
[5]Zhu, G., et al. (2019). "Author Correction: Targeting CLDN18.2 by CD3 Bispecific and ADC Modalities for the Treatments of Gastric and Pancreatic Cancer." Sci Rep 9(1): 16735.
[6]CSCO胃癌诊疗指南2023版.








评论